文章出處:行業動態 網責任編輯: 醫療器械全球注冊服務/體系認證/臨床試驗代理-瑞恩尼咨詢 閱讀量:339 發表時間:2024-08-27
微導管NMPA注冊要點
一、微導管的簡介
微導管通常由導管管身、不透射線標記、接頭等結構組成。管身通常較細且柔軟,表面可帶有親水涂層。用于向血管系統中注入診斷試劑(如造影劑)、治療試劑(如藥物制劑、栓塞材料)和適當的器械(如支架、彈簧圈)等。
微導管在冠狀動脈粥樣硬化性心臟病(冠心病)的介入治療領域,特別是在應對極具挑戰性的慢性閉塞病變(CTO)時,扮演著不可或缺且至關重要的角色。隨著全球心血管疾病發病率的持續攀升,以及患者對微創手術安全性、有效性追求的日益增長,先進的導管技術成為了推動醫療進步的關鍵力量。
微導管,憑借其超細的尺寸、卓越的靈活性和精確的操控性,完美契合了復雜冠脈介入手術的需求。它們能夠輕松穿越蜿蜒曲折、狹窄甚至閉塞的血管通道,為醫生提供了前所未有的治療路徑,實現了對病變部位的精準導航與干預。在CTO等復雜病變的介入治療中,微導管不僅提高了手術的成功率,還顯著降低了手術風險,減少了患者的痛苦與恢復時間。
市場層面,隨著醫療技術的不斷革新和臨床應用范圍的持續拓展,全球微導管市場的需求呈現出強勁的增長態勢。據預測,從2023年的439.25萬美元起,這一市場將經歷顯著擴張,預計到2032年將達到近824.69萬美元的市場規模,年復合增長率顯著,反映了微導管技術在心血管介入治療領域的廣泛應用前景和巨大市場潛力(數據來源于網絡)。
綜上所述,微導管作為冠心病介入治療,特別是CTO病變治療中的關鍵工具,正引領著心血管介入技術的革新與發展,為全球心血管疾病患者帶來更加安全、有效的治療選擇。
在中國,微導管的管理類別為III類,分類編碼為03-13-26微導管。本文根據《微導管注冊審查指導原則(2022年第4號)》并結合筆者以往經驗,對微導管的國內注冊重點關注點進行簡要介紹。
二、參考標準及指導原則
YY 0285.1-2017 血管內導管 一次性使用無菌導管 第1部分:通用要求;
GB/T 16886系列標準;
《微導管注冊審查指導原則(2022年第4號)》;
二、綜述資料編寫要求
1、產品名稱
一般以“微導管”作為核心詞,以結構特點、材料組成、使用部位等作為特征詞,例如“冠脈微導管”。
2、結構組成
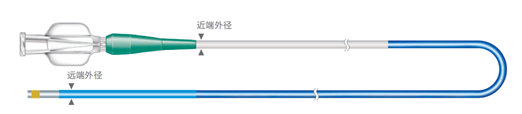
需提供微導管軸向剖面圖和橫截面圖;如果產品是多層結構設計,在橫截面圖上應能清晰識別出多層結構。
3、組成材料
※對于與人體接觸(直接/間接)的原材料,需要提供供應商信息、生產商信息、購買證明性文件、質量控制標準、入廠檢測報告。
※對于帶涂層的產品,需要提供涂層的涂覆范圍、涂覆方式;對于透明質酸成分的親水涂層,應明確透明質酸的來源,說明從動物組織提取還是通過微生物發酵法制備。
三、非臨床資料
1、產品技術要求
產品技術要求中性能指標應參考《微導管注冊審查指導原則(2022年第4號)》附件表1制定,如果不適用的項目,應說明理由。
對于帶涂層的產品,若涂層材料導致某項化學性能結果異常時,建議對無涂層產品進行測試,確認其化學性能是否可接受,同時結合涂層材料的臨床應用史及生物相容性數據,綜合評價。若涂層可安全用于人體,且無涂層產品化學性能結果正常,可不在產品技術要求中制定該項化學性能。(Tips:可以只取與人體接觸部分進行化學性能測試,如果測試結果合格,審評也是可以接受的,因此應從多方面來分析產品的安全性。)
2、產品性能研究
《微導管注冊審查指導原則(2022年第4號)》附件表1中列舉的性能指標均應提供確定依據及性能研究資料,如果不適用,應說明理由。
※性能研究資料中應明確樣本量及樣本量的確定依據。
3、穩定性研究
貨架有效期驗證項目包括產品自身性能和包裝系統性能兩方面,其中產品自身性能應包含產品技術要求中的全部性能(進口注冊時尤其要注意這一點)
四、臨床評價
微導管屬于《免于進行臨床評價醫療器械目錄》中的產品,如果超出免臨床目錄的要求,可以參考《血管內導管同品種對比臨床評價技術審查指導原則》進行同品種臨床評價或者進行臨床試驗。