日本PMDA注冊代理服務
醫療器械企業希望把產品投放到日本市場,必須要滿足日本的 Pharmaceutical and Medical Device Act (PMD Act)法規。
日本厚生勞動省(MHLW,全稱為“Ministry of Health, Labour and Welfare”)下屬部門:藥品和醫療器械局 (PMDA,全稱為“Pharmaceuticals and Medical Devices Agency”)是日本的監管機構。
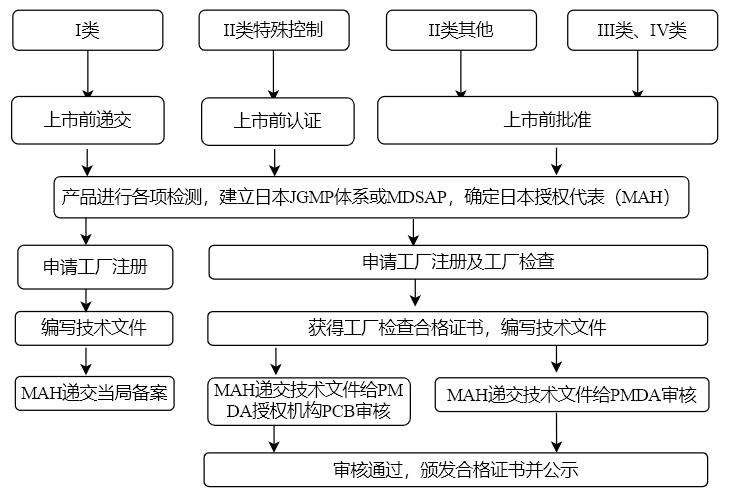
醫 療 器 械 必 須 要 由 其 市 場 合法授 權 代表 MAH ( Marketing Authorization Holder )通過以下程序去注冊其產品。
Class I 器械 - 上市前提交 Todokede
I類器械上市前必須由其 MAH或 DMAH向 PMDA 提交一份上市前提交文件,這份文件不需要經過 PMDA的審核和批準。
Class II 器械 - 上市前認證 Ninsho
作為特殊控制的 II 類器械上市前必須要經過上市前認證。認證機構(PCB)為 PMDA 授權可以進行 PMDA認證的機構。
Class II,III,IV 器械 - 上市前批準 Shonin
除了特殊控制的 II 類器械外的其他 II 類器械和 III,IV 類器械必須要由其 MAH 或 DMAH 像PMDA提交上市前批準的申請,并經過 PMDA批準后才能注冊他們的產品,并投放市場。
值得注意的是:境外的醫療器械進入日本注冊時只能由日本授權代表(MAH或DMAH)持證,境外的醫療器械制造商只獲得“醫療器械外國制造業者登陸證”(即體系審查合格證書)。
日本厚生勞動省(MHLW,全稱為“Ministry of Health, Labour and Welfare”)下屬部門:藥品和醫療器械局 (PMDA,全稱為“Pharmaceuticals and Medical Devices Agency”)是日本的監管機構。
醫 療 器 械 必 須 要 由 其 市 場 合法授 權 代表 MAH ( Marketing Authorization Holder )通過以下程序去注冊其產品。
Class I 器械 - 上市前提交 Todokede
I類器械上市前必須由其 MAH或 DMAH向 PMDA 提交一份上市前提交文件,這份文件不需要經過 PMDA的審核和批準。
Class II 器械 - 上市前認證 Ninsho
作為特殊控制的 II 類器械上市前必須要經過上市前認證。認證機構(PCB)為 PMDA 授權可以進行 PMDA認證的機構。
Class II,III,IV 器械 - 上市前批準 Shonin
除了特殊控制的 II 類器械外的其他 II 類器械和 III,IV 類器械必須要由其 MAH 或 DMAH 像PMDA提交上市前批準的申請,并經過 PMDA批準后才能注冊他們的產品,并投放市場。
值得注意的是:境外的醫療器械進入日本注冊時只能由日本授權代表(MAH或DMAH)持證,境外的醫療器械制造商只獲得“醫療器械外國制造業者登陸證”(即體系審查合格證書)。
- 立即咨詢
- 全國服務熱線:
0755-27391220